Industri Kimia Hilir
Industri Kimia: Produksi Zat Kimia dan Produknya dalam Berbagai Sektor
Dipublikasikan oleh Cindy Aulia Alfariyani pada 16 Mei 2024
Industri kimia merujuk pada suatu industri yang terlibat dalam produksi zat kimia. Industri ini mencakup petrokimia, agrokimia, farmasi, polimer, cat, dan oleokimia. Industri ini menggunakan proses kimia, termasuk reaksi kimia untuk membentuk zat baru, pemisahan berdasarkan sifat seperti kelarutan atau muatan ion, distilasi, transformasi oleh panas, serta metode-metode lain.
Industri kimia terlibat dalam pemrosesan bahan mentah yang diperoleh melalui penambangan, pertanian, dan sumber-sumber lain, menjadi material, zat kimia, serta senyawa kimia yang dapat berupa produk akhir atau produk antara yang akan digunakan di industri lain.
Polimer dan plastik, terutama polietilena, polipropilena, polivinil klorida, polietilena tereftalat, polistirena dan polikarbonat adalah sebagian besar hasil industri kimia. Kimia yang dihasilkan digunakan dalam berbagai macam barang rumah tangga, pertanian, konstruksi, serta industri jasa.
Penjualan bisnis kimia dapat dibedakan menjadi beberapa kategori, di antaranya kimia dasar (sekitar 35-37% hasil penjualan), ilmu sains (30%), kimia khusus (20-25%) dan produk rumah tangga (10%).
Kimia dasar adalah sebuah kategori kimia yang di dalamnya termasuk polimer, petrokimia dan turunannya, bahan kimia anorganik, dan pupuk.
Sub-kategori terbesar kimia dasar adalah plastik dan serat, yang produk-produknya antara lain:
- Volume dengan produk terbesar adalah polietilena yang umum digunakan pada botol susu, kontainer, dan pipa.
- Polivinil klorida (PVC), umum digunakan pada pipa konstruksi.
- Polipropilena (PP), mirip dengan PV, digunakan dalam pengepakan dan berbagai kebutuhan rumah tangga.
- Polistirena (PS), digunakan pada mainan anak-anak.
- Produk lainnya adalah serat sintetis termasuk poliester, nilon, serat akrilik
Untuk pabrik petrokimia dan turunannya umumnya mengambil bahan mentah dari elpiji, gas alam dan minyak mentah. Beberapa produknya antara lain etilena, propilena, benzena, toluena, xilena, metanol, monomer vinil klorida, stirena, butadiena, dan etilena oksida. Produk yang dihasilkan ini umumnya digunakan untuk memproduksi polimer lainnya.
Produk turunan lainnya di antara karet sintetis, surfaktan, pewarna, pigmen, terpentin, resin, karbon hitam, peledak dan produk karet lainnya. Kimia anorganik menghasilkan produk di antaranya garam, klorin, kaustik soda, natrium karbonat, asam (seperti asam nitrat, asam fosfat, dan asam sulfat), titanium dioksida, dan hidrogen peroksida. Untuk kategori pupuk, produknya antara lain fosfat, amonia, dan potash.
Ilmu sains mencakup di antaranya berbagai turunan kimia dan biologi, obat, diagnostik, produk kesehatan hewan, vitamin, dan pestisida. Meskipun secara volume sangat kecil, namun harganya sangat tinggi. Produk-produk ilmu sains ini umumnya diproduksi dengan spesifikasi sangat tinggi dan diawasi pemerintah. Pestisida yang termasuk juga di dalam kategori ini juga mencakup herbisida, insektisida, dan fungsisida.
Beberapa perusahaan kimia terbesar dunia antara lain BASF, Bayer, Ferro, Solvay, Braskem, Celanese/Ticona, Arkema, Degussa, Dow, DuPont, Eastman Chemical Company, ExxonMobil, Givaudan, INEOS, LG Chem, LyondellBasell, Mitsubishi, Monsanto, PPG Industries, SABIC, LANXESS, Shell, dan Wanhua beserta ribuan industri kecil lainnya.
Dari penglihatan insinyur kimia, industri kimia menggunakan proses kimia seperti reaksi kimia dan metode pengilangan untuk memproduksi material dalam bentuk padat, cair, maupun gas. Kebanyakan produknya digunakan untuk memproduksi barang lainnya dan hanya sedikit saja yang langsung digunakan pada konsumen. Pelarut, pestisida, natrium karbonat, dan semen merupakan beberapa produk kimia yang langsung dipakai konsumen.
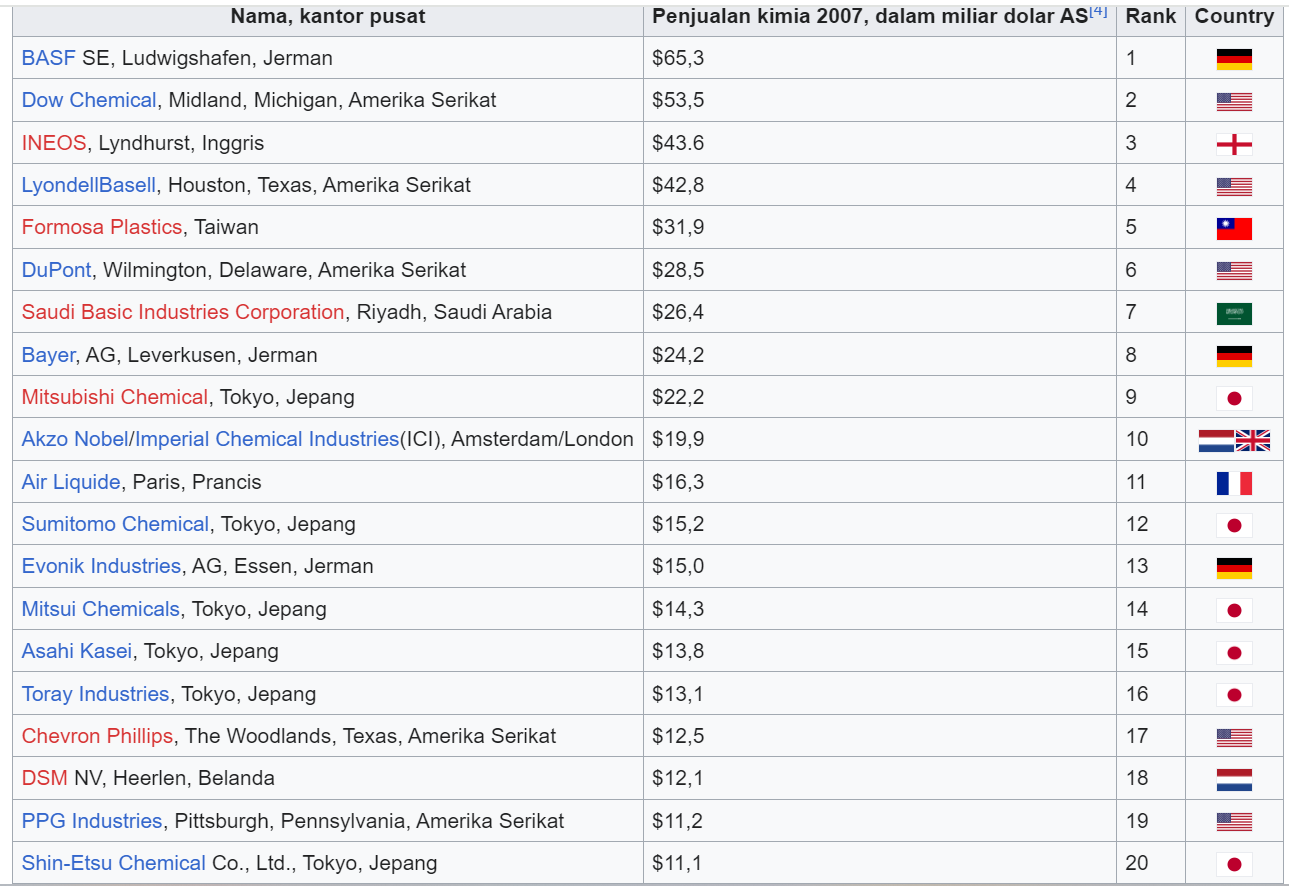
Industri kimia juga memproduksi bahan kimia industri organik dan anorganik, produk keramik, petrokimia, agrokimia, polimer, karet, oleokimia (minyak, lemak, wax), peledak, dan aroma buatan. Beberapa produknya ditampilkan pada tabel berikut.

Proses-proses kimia seperti reaksi kimia digunakan pada pabrik kimia untuk membentuk senyawa baru dengan berbagai macam tipe tangki reaktor. Di banyak kasus reaksinya dilakukan pada peralatan khusus anti-karat pada suhu dan tekanan tertentu dengan bantuan katalis. Produk reaksi ini dipisahkan dengan berbagai teknik di antaranya distilasi seperti distilasi fraksional, pengendapan, kristalisasi, adsorpsi, filtrasi, sublimasi, dan pengeringan.
Proses dan produk umumnya diuji selama dan setelah proses dengan menggunakan instrumen atau alat tertentu untuk memastikan operasi berjalan aman dan produk yang dibutuhkan sesuai dengan spesifikasi tertentu. Produk ini dikirimkan dengan banyak cara, termasuk jalur pipa, mobil tanki, silinder, botol, drum, kotak, dsb. Sebuah perusahaan kimia umumnya mempunyai laboratorium penelitian dan pengembangan untuk menguji dan mengembangkan proses serta produk mereka.
Industri kimia mencakup perusahaan besar, menengah, dan kecil di seluruh dunia. Salah satu industri kimia yang ada di Indonesia adalah Pertamina, yang mengolah minyak mentah mejadi bahan bakar. Perusahaan dengan penjualan lebih dari 10 miliar dolar tahun 2007 ada dalam daftar ini. Beberapa perusahaan hanya menampakkan sebagian dari total penjualan mereka (misalnya penjualan kimia ExxonMobil hanya 8,7% total penjualan mereka tahun 2005).
Sumber: id.wikipedia.org
Industri Kimia Hilir
Inovasi IoT: Sistem Penyadapan Karet Otomatis Meningkatkan Kualitas Panen dan Kesejahteraan Petani Karet di Indonesia
Dipublikasikan oleh Cindy Aulia Alfariyani pada 16 Mei 2024
Tim mahasiswa Fakultas Teknik Mesin dan Dirgantara (FTMD) berhasil mengembangkan sistem penyadapan karet otomatis berbasis Internet of Things (IoT) untuk meningkatkan kualitas hasil panen karet di Indonesia. Tim yang dibentuk untuk mengikuti Program Kreativitas Mahasiswa - Karya Inovatif (PKM-KI) ini beranggotakan empat orang, yaitu Yuman Satriadi (Teknik Dirgantara '20) sebagai ketua tim, Pande Nyoman Dharmayasa Sugiana (Teknik Mesin '20), Muhammad Rafiuddin Rasyid (Teknik Mesin '20), dan Muhammad Hilmi Fawwaz (Teknik Telekomunikasi '20, STEI ITB).
Di bawah bimbingan Dr. Aditianto Ramelan dan dengan pendanaan dari Belmawa, inovasi tim ini berhasil meraih juara 1 (setara dengan emas) dalam kategori presentasi pada Pekan Ilmiah Mahasiswa Nasional (P;'p'
IMNAS) ke-35 yang diselenggarakan di Universitas Muhammadiyah Malang pada tanggal 29 November hingga 4 Desember 2022.
Ide proyek, Sistem Penyadapan Karet Otomatis, berasal dari ketua tim, Yuman Satriadi, yang menyadari potensi untuk meningkatkan sumber daya petani karet dengan meningkatkan proses penyadapan karet. Tim menemukan bahwa harga karet di Indonesia cenderung rendah karena sebagian besar petani masih menggunakan metode penyadapan konvensional yang tidak sesuai dengan waktu yang optimal, sehingga menghasilkan produksi karet yang berkualitas rendah.
Untuk mengatasi hal tersebut, tim PKM-KI mengembangkan alat penyadap karet otomatis yang dilengkapi dengan mekanisme pemilahan kualitas karet. Alat ini dirancang dengan ketebalan pemotongan yang presisi untuk memenuhi standar kualitas karet yang baik. Dalam pengujiannya, alat ini terbukti lebih efektif dan efisien dibandingkan dengan metode penyadapan konvensional yang masih banyak digunakan oleh petani.
Selain itu, inovasi ini menggabungkan teknologi IoT yang memungkinkan petani untuk memantau kondisi pohon karet secara real-time, sehingga mereka dapat dengan mudah dan efisien menentukan waktu penyadapan yang tepat.
Dalam proyek ini, mereka memanfaatkan mikrokontroler dan logam untuk menciptakan alat yang membantu transportasi pohon karet. Mereka melakukan berbagai percobaan untuk menguji desain dan sistem yang mereka kembangkan.
Tantangan terbesar yang mereka hadapi adalah terkait dengan pengujian, mengingat jarak yang cukup jauh antara tempat pengujian dan tempat tinggal mereka. Namun, Dr. Aditianto Ramelan memberikan bimbingan dan dukungan untuk mengatasi kendala ini.
Setelah mengatasi berbagai tantangan dan melakukan perbaikan, alat yang dikembangkan relatif terjangkau dan sangat efektif dalam meningkatkan pendapatan petani. Selain itu, alat ini mudah diproduksi dalam skala industri, dengan desain sistem yang disederhanakan. Inovasi ini memiliki potensi untuk memberikan kontribusi yang besar bagi industri karet Indonesia dan meningkatkan kesejahteraan petani karet.
Disadur dari: ftmd.itb.ac.id
Teknologi Otomotif
Evolusi Ban: Dari Ban Kayu ke Ban Pneumatik Modern dan Dampaknya pada Industri Otomotif
Dipublikasikan oleh Cindy Aulia Alfariyani pada 16 Mei 2024
Berbagai macam ban jalan raya otomotif baru, menunjukkan berbagai pola tapak.
Ban traktor memiliki rusuk dan rongga yang cukup besar untuk traksi di medan yang lunak.
Ban (bahasa Inggris Amerika Utara) atau tyre (bahasa Inggris Persemakmuran) adalah komponen berbentuk cincin yang mengelilingi pelek roda untuk memindahkan beban kendaraan dari as roda melalui roda ke tanah dan untuk memberikan traksi pada permukaan yang dilalui roda. Sebagian besar ban, seperti ban untuk mobil dan sepeda, merupakan struktur yang dipompa secara pneumatik, memberikan bantalan fleksibel yang menyerap guncangan saat ban menggelinding di atas permukaan yang kasar. Ban menyediakan tapak, yang disebut tambalan kontak, yang dirancang untuk menyesuaikan dengan berat kendaraan dan bantalan pada permukaan yang dilaluinya dengan mengerahkan tekanan yang akan menghindari perubahan bentuk pada permukaan.
Bahan-bahan ban pneumatik modern adalah karet sintetis, karet alam, kain, dan kawat, serta karbon hitam dan senyawa kimia lainnya. Ban ini terdiri dari tapak dan badan ban. Tapak ban menyediakan traksi sementara badan ban menyediakan penahanan untuk sejumlah udara bertekanan. Sebelum karet dikembangkan, ban adalah pita logam yang dipasang di sekitar roda kayu untuk menahan roda bersama di bawah beban dan untuk mencegah keausan. Ban karet awal berbentuk padat (bukan pneumatik). Ban pneumatik digunakan pada banyak kendaraan, termasuk mobil, sepeda, sepeda motor, bus, truk, alat berat, dan pesawat terbang. Ban logam digunakan pada lokomotif dan gerbong kereta api, dan ban karet padat (atau polimer lainnya) juga digunakan pada berbagai aplikasi non-otomotif, seperti kastor, gerobak, mesin pemotong rumput, dan gerobak dorong.

Ban yang tidak terawat dapat menyebabkan bahaya besar bagi kendaraan dan manusia, mulai dari ban kempes sehingga kendaraan tidak dapat beroperasi hingga meledak, di mana ban meledak saat beroperasi dan dapat merusak kendaraan serta melukai orang. Pembuatan ban sering kali sangat diatur karena alasan ini. Karena meluasnya penggunaan ban untuk kendaraan bermotor, limbah ban merupakan bagian penting dari limbah global. Ada kebutuhan untuk mendaur ulang ban melalui daur ulang mekanis dan penggunaan kembali, seperti untuk karet remah dan agregat yang berasal dari ban, dan pirolisis untuk penggunaan kembali secara kimiawi, seperti untuk bahan bakar yang berasal dari ban. Jika tidak didaur ulang dengan benar atau dibakar, limbah ban akan melepaskan bahan kimia beracun ke lingkungan. Selain itu, penggunaan ban secara teratur menghasilkan partikel mikro-plastik yang mengandung bahan kimia ini yang masuk ke lingkungan dan mempengaruhi kesehatan manusia.
Etimologi dan ejaan
Kata ban adalah bentuk singkat dari pakaian, dari gagasan bahwa roda dengan ban adalah roda berpakaian.
Ejaan tyre tidak muncul hingga tahun 1840-an ketika Inggris mulai mengecilkan roda mobil kereta api dengan besi lunak. Namun demikian, penerbit tradisional terus menggunakan ban. Surat kabar Times di London masih menggunakan ban hingga tahun 1905. Ejaan ban mulai umum digunakan pada abad ke-19 untuk ban pneumatik di Inggris. Encyclopædia Britannica edisi 1911 menyatakan bahwa "Ejaan 'tyre' sekarang tidak diterima oleh otoritas bahasa Inggris terbaik, dan tidak diakui di Amerika Serikat", sementara Fowler's Modern English Usage tahun 1926 menjelaskan bahwa "tidak ada yang dapat dikatakan untuk 'tyre', yang secara etimologis salah, serta tidak perlu berbeda dari penggunaan bahasa Inggris yang lebih tua dan penggunaan bahasa Amerika saat ini". Namun, selama abad ke-20, tyre ditetapkan sebagai ejaan standar Inggris.
Sejarah
John Boyd Dunlop di atas sepeda, sekitar tahun 1915
Ban paling awal adalah pita kulit, kemudian besi (kemudian baja) yang diletakkan di atas roda kayu yang digunakan pada gerobak dan gerobak. Seorang pekerja terampil, yang dikenal sebagai tukang besi, akan membuat ban mengembang dengan memanaskannya di dalam tungku, meletakkannya di atas roda, dan memadamkannya, sehingga menyebabkan logam menyusut kembali ke ukuran aslinya agar pas di roda.
Paten pertama untuk apa yang tampak sebagai ban pneumatik standar muncul pada tahun 1847 dan diajukan oleh penemu asal Skotlandia, Robert William Thomson. Namun, ide ini tidak pernah diproduksi. Ban pneumatik praktis pertama dibuat pada tahun 1888 di May Street, Belfast, oleh John Boyd Dunlop kelahiran Skotlandia, pemilik salah satu praktik dokter hewan paling sukses di Irlandia. Ban ini dibuat sebagai upaya untuk mencegah sakit kepala putranya yang berusia 10 tahun, Johnnie, ketika mengendarai sepeda roda tiga di trotoar yang kasar. Dokternya, John, yang kemudian dikenal sebagai Sir John Fagan, telah meresepkan bersepeda sebagai latihan untuk anak laki-laki itu dan merupakan pengunjung tetap. Fagan berpartisipasi dalam mendesain ban pneumatik pertama. Pesepeda Willie Hume menunjukkan keunggulan ban Dunlop pada tahun 1889, dengan memenangkan perlombaan pertama ban ini di Irlandia dan kemudian Inggris. Dalam spesifikasi paten ban Dunlop tertanggal 31 Oktober 1888, ia hanya tertarik pada penggunaannya untuk sepeda dan kendaraan ringan. Pada bulan September 1890, ia mengetahui adanya pengembangan lebih awal, namun perusahaan menyimpan informasi tersebut untuk dirinya sendiri.
Pada tahun 1892, paten Dunlop dinyatakan tidak valid karena penemuan sebelumnya oleh sesama orang Skotlandia yang terlupakan, Robert William Thomson dari London (paten London 1845, Prancis 1846, Amerika Serikat 1847). Namun, Dunlop dikreditkan dengan "menyadari bahwa karet dapat menahan keausan sebagai ban sekaligus mempertahankan ketahanannya". John Boyd Dunlop dan Harvey du Cros berhasil mengatasi kesulitan yang cukup besar. Mereka mempekerjakan penemu Charles Kingston Welch dan memperoleh hak dan paten lainnya, yang memberikan mereka perlindungan terbatas terhadap posisi bisnis Pneumatic Tyre mereka. Ban Pneumatik kemudian menjadi Dunlop Rubber dan Ban Dunlop. Pengembangan teknologi ini bergantung pada berbagai kemajuan teknik, termasuk vulkanisasi karet alam menggunakan belerang, serta pengembangan pelek "penjepit" untuk menahan ban pada tempatnya secara lateral pada pelek roda.
Karet sintetis ditemukan di laboratorium Bayer pada tahun 1920-an. Kekurangan karet di Inggris selama Perang Dunia II mendorong penelitian tentang alternatif untuk ban karet dengan saran termasuk kulit, asbes terkompresi, rayon, kain kempa, bulu, dan kertas.
Pada tahun 1946, Michelin mengembangkan metode konstruksi ban radial. Michelin telah membeli perusahaan mobil Citroën yang bangkrut pada tahun 1934 untuk memanfaatkan teknologi baru ini. Karena keunggulannya dalam pengendalian dan penghematan bahan bakar, penggunaan teknologi ini dengan cepat menyebar ke seluruh Eropa dan Asia. Di AS, konstruksi ban bias-ply yang sudah ketinggalan zaman bertahan hingga Ford Motor Company mengadopsi ban radial pada awal tahun 1970-an, setelah sebuah artikel tahun 1968 di sebuah majalah Amerika yang berpengaruh, Consumer Reports, yang menyoroti keunggulan konstruksi radial. Industri ban AS kehilangan pangsa pasarnya kepada produsen Jepang dan Eropa, yang membeli perusahaan-perusahaan AS.
Disadur dari: en.wikipedia.org
Industri Farmasi
Transformasi Industri Kimia: Dari Bahan Baku Menuju Produksi Bahan Kimia Modern
Dipublikasikan oleh Cindy Aulia Alfariyani pada 16 Mei 2024
"Bahan baku" dialihkan ke sini. Untuk kegunaan lain, lihat Bahan baku (disambiguasi).
Bahan mentah, juga dikenal sebagai bahan baku, bahan yang belum diproses, atau komoditas primer, adalah bahan dasar yang digunakan untuk memproduksi barang, barang jadi, energi, atau bahan setengah jadi yang menjadi bahan baku untuk produk jadi di masa depan. Sebagai bahan baku, istilah ini menunjukkan bahwa bahan-bahan ini merupakan aset yang menghambat dan diperlukan untuk menghasilkan produk lain.
Istilah bahan baku menunjukkan bahan yang belum diolah atau diolah secara minimal seperti lateks mentah, minyak mentah, kapas, batu bara, biomassa mentah, bijih besi, plastik, udara, kayu gelondongan, dan air. Istilah bahan baku sekunder menunjukkan bahan limbah yang telah didaur ulang dan disuntikkan kembali untuk digunakan sebagai bahan produktif.
Bahan baku dalam rantai pasokan

Rantai pasokan biasanya dimulai dengan akuisisi atau ekstraksi bahan baku. Misalnya, Komisi Eropa mencatat bahwa rantai pasokan makanan dimulai pada fase pertanian produksi makanan.
Laporan tahun 2022 tentang perubahan yang memengaruhi perdagangan internasional mencatat bahwa peningkatan sumber bahan baku telah menjadi salah satu tujuan utama perusahaan dalam mengkonfigurasi ulang rantai pasokan mereka.
Dalam survei tahun 2022 yang dilakukan oleh SAP, di mana 400 pemimpin logistik dan rantai pasokan yang berbasis di AS diwawancarai, 44% responden mengutip kurangnya bahan baku sebagai alasan masalah rantai pasokan mereka. Perkiraan untuk tahun 2023, 50% responden memperkirakan berkurangnya ketersediaan bahan baku di AS akan mendorong gangguan rantai pasokan.
Pasar bahan baku
Pasar bahan baku dipengaruhi oleh perilaku konsumen, ketidakpastian rantai pasokan, gangguan produksi, dan peraturan, di antara faktor-faktor lainnya. Hal ini mengakibatkan pasar bahan baku yang tidak stabil yang sulit untuk dioptimalkan dan dikelola. Perusahaan dapat mengalami kesulitan ketika dihadapkan pada volatilitas bahan baku karena kurangnya pemahaman tentang permintaan pasar, visibilitas yang buruk atau tidak adanya visibilitas ke dalam rantai pasokan tidak langsung, dan jeda waktu perubahan harga bahan baku.
Volatilitas di pasar bahan baku juga dapat disebabkan oleh bencana alam dan konflik geopolitik. Pandemi COVID-19 mengganggu industri baja, dan begitu permintaan pulih, harga naik 250% di AS. Perang di Ukraina menyebabkan harga gas alam meningkat 50% pada tahun 2022.
Pengolahan bahan baku
Keramik
Meskipun tembikar berasal dari berbagai tempat di seluruh dunia, dapat dipastikan bahwa tembikar dikenal sebagian besar melalui Revolusi Neolitikum. Hal ini penting karena ini merupakan cara bagi para agraris pertama untuk menyimpan dan membawa kelebihan persediaan. Meskipun sebagian besar guci dan pot terbuat dari keramik tanah liat api, masyarakat Neolitikum juga menciptakan tungku pembakaran yang dapat membakar bahan tersebut untuk menghilangkan sebagian besar air untuk menciptakan bahan yang sangat stabil dan keras. Tanpa adanya tanah liat di tepi sungai Tigris dan Eufrat di Bulan Sabit Subur, tanur semacam itu tidak mungkin dibuat oleh orang-orang di wilayah tersebut. Dengan menggunakan tungku-tungku ini, proses metalurgi menjadi mungkin ketika Zaman Perunggu dan Zaman Besi tiba pada orang-orang yang tinggal di sana.
Logam
Banyak bahan logam mentah yang digunakan dalam keperluan industri harus diproses terlebih dahulu menjadi bentuk yang dapat digunakan. Bijih logam pertama-tama diproses melalui kombinasi penghancuran, pemanggangan, pemisahan magnetik, pengapungan, dan pencucian agar sesuai untuk digunakan dalam pengecoran. Pabrik pengecoran kemudian melebur bijih menjadi logam yang dapat digunakan yang dapat dipadukan dengan bahan lain untuk meningkatkan sifat-sifat tertentu. Salah satu bahan baku logam yang banyak ditemukan di seluruh dunia adalah besi, dan jika dikombinasikan dengan nikel, bahan ini membentuk lebih dari 35% material di inti dalam dan luar bumi. Besi yang awalnya digunakan sejak 4000 SM disebut besi meteorik dan ditemukan di permukaan Bumi. Jenis besi ini berasal dari meteorit yang menghantam Bumi sebelum manusia muncul, dan persediaannya sangat terbatas. Jenis ini tidak seperti kebanyakan besi di Bumi, karena besi di Bumi jauh lebih dalam daripada yang bisa digali oleh manusia pada periode waktu itu. Kandungan nikel pada besi meteorik membuatnya tidak perlu dipanaskan, dan sebagai gantinya, besi tersebut dipalu dan dibentuk menjadi perkakas dan senjata.
Bijih besi

Bijih besi dapat ditemukan dalam berbagai bentuk dan sumber. Bentuk utama bijih besi saat ini adalah Hematit dan Magnetit. Meskipun bijih besi dapat ditemukan di seluruh dunia, hanya deposit dalam jumlah jutaan ton yang diproses untuk keperluan industri. Lima eksportir bijih besi terbesar adalah Australia, Brasil, Afrika Selatan, Kanada, dan Ukraina. Salah satu sumber pertama bijih besi adalah besi rawa. Besi rawa berbentuk bintil-bintil seukuran kacang polong yang terbentuk di bawah rawa gambut di dasar pegunungan.
Disadur dari: en.wikipedia.org
Pekerjaan Umum dan Perumahan Rakyat
Kemnaker Ajak ASEAN-OSHNET Tekan Kecelakaan Kerja di Sektor Konstruksi
Dipublikasikan oleh Natasya Anggita Saputri pada 16 Mei 2024
Berbagai upaya peningkatan pelaksanaan dan penelitian Keselamatan dan Kesehatan Kerja (K3) di bidang konstruksi telah dilakukan. Namun, masih banyak hal yang perlu diteliti, terutama untuk justifikasi ekonomi yang memerlukan kajian lebih lanjut. Untuk itu, Indonesia melalui Kementeriaan Ketenagakerjaan menyelenggarakan ASEAN-OSHNET The 1st Workshop Research on Economic Justification of Occupational Safety and Health Implementation in the Construction Sector (Penelitian Justifikasi Ekonomi Pelaksanaan Keselamatan dan Kesehatan Kerja di Sektor Konstruksi).
Workshop penelitian ini diselenggarakan selama dua hari, yakni pada Rabu-Kamis (13-14/10/2021) secara virtual dan diikuti semua negara anggota ASEAN. Direktur Jenderal Pembinaan Pengawasan Ketenagakerjaan dan Keselamatan dan Kesehatan Kerja (Binwasnaker dan K3) Haiyani Rumondang menyatakan bahwa, workshop penelitian ini penting mengingat sektor konstruksi memiliki risiko K3 yang tinggi.
"Melalui kegiatan penelitian ini diharapkan dapat membantu menekan kecelakaan kerja melalui pendekatan justifikasi ekonomi di sektor konstruksi. Kalau kecelakaan kerja bisa ditekan, maka pada akhirnya akan meningkatkan produktivitas kerja," ujarnya.
Merujuk siaran pers ILO pada 17 September 2021, ILO dan WHO memperkirakan hampir dua juta orang meninggal karena penyakit dan cedera akibat kerja. Kecelakaan dan penyakit akibat kerja mengurangi produktivitas, membebani sistem kesehatan, dan dapat berdampak pada pendapatan pekerja.
Oleh karena itu, sambungnya, pemerintah, pengusaha, dan pekerja perlu bekerja sama untuk mengambil tindakan guna mengurangi kecelakaan dan penyakit akibat kerja mengingat rentannya bahaya di tempat kerja, khususnya di sektor konstruksi. "Pimpinan kami, Ibu Menteri Ketenagakerjaan, Ida Fauziyah juga dalam berbagai kesempatan sangat menekankan pentingnya K3 di tempat kerja, terutama di sektor konstruksi yang rentan akan bahaya kecelakaan dan penyakit akibat kerja," ucapnya.
Sumber: nasional.sindonews.com
Industri Kimia Hilir
Transformasi Industri Kimia: Dari Revolusi Industri hingga Produksi Bahan Kimia Modern
Dipublikasikan oleh Cindy Aulia Alfariyani pada 16 Mei 2024
Industri kimia terdiri dari perusahaan-perusahaan dan organisasi-organisasi lain yang mengembangkan dan memproduksi bahan kimia industri, khusus dan bahan kimia lainnya. Industri ini merupakan pusat ekonomi dunia modern, yang mengubah bahan mentah (minyak, gas alam, udara, air, logam, dan mineral) menjadi bahan kimia komoditas untuk produk industri dan konsumen. Industri ini mencakup industri petrokimia seperti polimer untuk plastik dan serat sintetis; bahan kimia anorganik seperti asam dan basa; bahan kimia pertanian seperti pupuk, pestisida, dan herbisida; serta kategori lain seperti gas industri, bahan kimia khusus, dan obat-obatan. Berbagai profesional terlibat dalam industri kimia termasuk insinyur kimia, ahli kimia, dan teknisi laboratorium.
Sejarah
Meskipun bahan kimia dibuat dan digunakan sepanjang sejarah, kelahiran industri kimia berat (produksi bahan kimia dalam jumlah besar untuk berbagai penggunaan) bertepatan dengan dimulainya Revolusi Industri.
Revolusi Industri

Salah satu bahan kimia pertama yang diproduksi dalam jumlah besar melalui proses industri adalah asam sulfat. Pada tahun 1736, apoteker Joshua Ward mengembangkan proses produksi asam sulfat yang melibatkan pemanasan sulfur dengan sendawa, sehingga sulfur teroksidasi dan bercampur dengan air. Ini adalah produksi praktis pertama asam sulfat dalam skala besar. John Roebuck dan Samuel Garbett adalah orang pertama yang mendirikan pabrik berskala besar di Prestonpans, Skotlandia, pada tahun 1749, yang menggunakan ruang kondensasi timbal untuk pembuatan asam sulfat.
Rollox Chemical Works milik Charles Tennant pada tahun 1831, yang saat itu merupakan perusahaan kimia terbesar di dunia.
Pada awal abad ke-18, kain diputihkan dengan cara mengobatinya dengan air seni basi atau susu asam dan mengeksposnya ke sinar matahari dalam jangka waktu yang lama, yang menyebabkan kemacetan parah dalam produksi. Asam sulfat mulai digunakan sebagai bahan yang lebih efisien dan juga kapur pada pertengahan abad ini, tetapi penemuan bubuk pemutih oleh Charles Tennant-lah yang mendorong terciptanya perusahaan industri kimia pertama yang besar. Bubuknya dibuat dengan mereaksikan klorin dengan kapur mati kering dan terbukti menjadi produk yang murah dan sukses. Dia membuka St Rollox Chemical Works, di utara Glasgow, dan produksinya meningkat dari hanya 52 ton pada tahun 1799 menjadi hampir 10.000 ton hanya dalam waktu lima tahun.
Soda ash telah digunakan sejak zaman kuno dalam produksi kaca, tekstil, sabun, dan kertas, dan sumber kalium secara tradisional adalah abu kayu di Eropa Barat. Pada abad ke-18, sumber ini menjadi tidak ekonomis karena penggundulan hutan, dan Akademi Ilmu Pengetahuan Prancis menawarkan hadiah sebesar 2400 livre untuk metode yang dapat menghasilkan alkali dari garam laut (natrium klorida). Proses Leblanc dipatenkan pada tahun 1791 oleh Nicolas Leblanc yang kemudian membangun pabrik Leblanc di Saint-Denis. Dia tidak mendapatkan hadiah uangnya karena Revolusi Prancis.
Di Inggris, proses Leblanc menjadi populer. William Losh membangun pabrik soda pertama di Inggris di pabrik Losh, Wilson dan Bell di Sungai Tyne pada tahun 1816, tetapi tetap dalam skala kecil karena tarif yang tinggi untuk produksi garam hingga tahun 1824. Ketika tarif ini dicabut, industri soda Inggris dapat berkembang pesat. Pabrik kimia milik James Muspratt di Liverpool dan kompleks milik Charles Tennant di dekat Glasgow menjadi pusat produksi bahan kimia terbesar di dunia. Pada tahun 1870-an, produksi soda Inggris mencapai 200.000 ton per tahun, melebihi produksi semua negara lain di dunia.

Pabrik-pabrik besar ini mulai memproduksi bahan kimia yang lebih beragam seiring dengan berkembangnya Revolusi Industri. Awalnya, sejumlah besar limbah alkali dibuang ke lingkungan dari produksi soda, yang memicu salah satu undang-undang lingkungan pertama yang disahkan pada tahun 1863. Undang-undang ini mengatur pemeriksaan ketat terhadap pabrik-pabrik dan menjatuhkan denda besar bagi mereka yang melebihi batas polusi. Metode-metode dirancang untuk membuat produk sampingan yang berguna dari alkali.
Proses Solvay dikembangkan oleh ahli kimia industri Belgia, Ernest Solvay, pada tahun 1861. Pada tahun 1864, Solvay dan saudaranya Alfred membangun sebuah pabrik di Charleroi, Belgia. Pada tahun 1874, mereka memperluas pabrik yang lebih besar di Nancy, Perancis. Proses baru ini terbukti lebih ekonomis dan lebih sedikit polusi daripada metode Leblanc, dan penggunaannya menyebar. Pada tahun yang sama, Ludwig Mond mengunjungi Solvay untuk mendapatkan hak untuk menggunakan prosesnya, dan dia dan John Brunner membentuk Brunner, Mond & Co, dan membangun pabrik Solvay di Winnington, Inggris. Mond berperan penting dalam membuat proses Solvay sukses secara komersial. Dia melakukan beberapa penyempurnaan antara tahun 1873 dan 1880 yang menghilangkan produk sampingan yang dapat menghambat produksi natrium karbonat dalam proses tersebut.
Pembuatan produk kimia dari bahan bakar fosil dimulai dalam skala besar pada awal abad ke-19. Residu tar batubara dan cairan amoniak dari pembuatan gas batubara untuk penerangan gas mulai diproses pada tahun 1822 di Bonnington Chemical Works di Edinburgh untuk membuat nafta, minyak pitch (kemudian disebut creosote), pitch, jelaga (karbon hitam), dan sal amoniak (amonium klorida). Pupuk amonium sulfat, aspal permukaan jalan, minyak kokas dan kokas kemudian ditambahkan ke dalam lini produk.
Disadur dari: en.wikipedia.org
